D - Asymmetrische Organokatalyse
In der asymmetrischen Organokatalyse werden Reaktionen durch (in der Regel) kleine chirale Moleküle katalysiert. Wir haben die asymmetrische Addition von Alkoholen an elektronenarme Alkene (oxa-Michael Reaktionen) untersucht und uns mit der Anwendung von Cinchona Alkaloiden (bzw. ihrer Derivate) als chirale Organokatalysatoren beschäftigt, sowie mit dem Studium der entsprechenden Reaktionsmechanismen.
D-1 - Asymmetrische katalytische oxa-Michael Cyclisierungen
Asymmetrische katalytische Additionen von Akoholen an Michael-Akzeptoren (oxa-Michael Reaktionen) sind aufgrund der geringen Nucleophilie der Alkohole lange wenig entwickelt geblieben.
Wir haben die asymmetrische Cyclisierung von 2-Hydroxychalconen zu Flavanonen als Modellreaktion der biosynthetischen Chalcon Isomerase-Reaktion untersucht (Eur. J. Org. Chem. 2007, 5886; Eur. J. Org. Chem. 2012, 5573).
Weitere Arbeiten zum Mechanismus der Cinchona-Alkaloid katalysierten oxa-Michael Cyclisierung sind ausgeführt worden (Chem. Eur. J. 2013, 19, 2311).
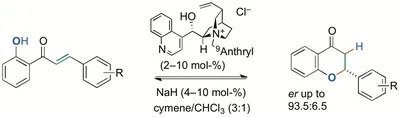
D-2 - Asymmetrische organokatalytische Olefin-Isomerisierung
Wir haben eine asymmetrische organokatalytische Isomerisierung einer Doppelbindung mit bifunktionellen Cinchona-Alkaloiden realisiert. meso-3-Phospholene als Edukte ergeben chirale 2-Phospholene (bis 83% ee; Adv. Synth. Cat. 2008, 350, 1469).
Die Umwandlung der 2-Phospholene zu einem C2-symmetrischen Phospholan, Fiaud's Säure (1), als nützlichem Edukt zur Synthese chiraler Phospholanliganden, ist realisiert worden (Synthesis 2013, 45, 308).
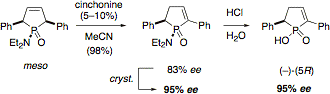

D-3 - Derivatisierungen von Cinchona-Alkaloiden
Lithiumalkyle addieren sich an die 2'-Position des Chinolinrests der ungeschützten Cinchona Alkaloide (Chinin, Chinidin, Cinchonin, Cinchonidin), wodurch 2'-Aryl- und -Alkyl-substituierte Cinchona Alkaloide leicht direkt zugänglich sind.
Die Reaktion derselben Alkaloide mit Grignard-Reagenzien führte überraschend zur neuen Klasse der Cinchona-Aminale mit verblüffenden Strukturen (Angew. Chem. 2007, 119, 5256).
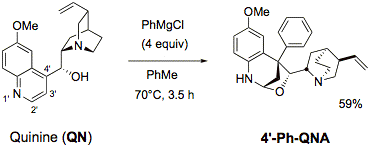
Die neuen Derivatisierungsmöglichkeiten haben einen Zugang zu vielen nicht natürlich vorkommenden Cinchona-Derivaten mit komplexer Architektur eröffnet (Angew. Chem. 2007, 119, 5256).