Über die Veranstaltung
Die Vorlesung vermittelt Grundlagen der Organischen Chemie und wendet sich damit an Studierende in den Bachelor-Studiengängen Biochemie, Chemie, Lebensmittelchemie, Molekulare Biotechnologie und sowie an Studierende im Lehramt (Gymnasium) und TUM-BWL. Die Einführung gibt Einblicke in grundlegende organisch-chemische Reaktionstypen, die Beurteilung und Vorhersage von Reaktivitäten, und Aspekte der Reaktionsführung. Es werden die wichtigsten Namensreaktionen in der organischen Synthese behandelt. Exkurse zeigen die Bedeutung der Reaktionen in der Biochemie und für industrielle Prozesse auf.
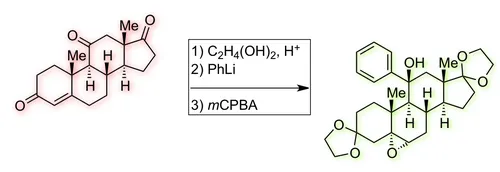
Im Schema ist gezeigt, wie das Edukt Adrenosteron A in einer kurzen Sequenz in ein komplexeres Produkt umgewandelt wird. Dieses Reaktionsbeispiel illustriert eine Strategie zur Gewinnung von Screeningkandidaten für die Suche nach Wirkstoffen (z. B. für Medikamente), ausgehend von einfach zugänglichen Naturstoffen. Können Sie die Umwandlung verstehen und erklären? Mit dem Wissen aus der Vorlesung sollte dies möglich sein, so dass Sie lediglich auf Basis des gezeigten Schemas einen detaillierten Reaktionsmechanismus aufzeichnen können!
Inhalte
1 Einführung
Thema der Vorlesung Reaktivität organischer Verbindungen, Konventionen zur Darstellung von Strukturformeln und mechanistischer Schemata
2 Theorien zur Chemischen Reaktivität
Thermodynamik und Kinetik, Chemisches Gleichgewicht, Zum Begriff der Stabilität, Thermodynamische vs. kinetische Kontrolle, Katalyse
3 Klassifizierung Organischer Reaktionen
Grundlegende Reaktionstypen nach struktureller Änderung, Reaktionstypen nach Art des Reagens, nach Art der Bindungsspaltung, Klassifikation von Reaktionen nach Selektivität
4 Reaktive Zwischenstufen
Reaktive Zwischenstufen und grundlegende Reaktivitäten
5 Säure-Base-chemie Organischer Verbindungen
Säure-Base Grundlagen und Konzepte, Einflussfaktoren auf die Acidität/Basizität, Wichtige Basen und C–H-Säuren in der organischen Chemie.
6 Elektrophil-Nucleophil Reaktionen
Bindungsbildung am Modell der Elektrophil-Nucleophil-Reaktion, Elektrophile und Nucleophile in der Organischen Chemie - Wichtige SN-Reaktionen, Aktivierung von Alkoholen zu starken Elektrophilen, Nachbargruppeneffekte
7 Eliminierung und Fragmentierung
Hydro-Hetero-Eliminierung zu Alkinen und (Hetero)Kumulenen, , Cyclische syn-Eliminierung, Dehydratisierung von Alkoholen (Hydro-Hydroxy-Eliminierung), Reduktive Eliminierung aus 1,2-Halo-hetero-Verbindungen, Fragmentierung
8 Addition an CC-Mehrfachbindungen
Bimolekulare elektrophile Addition vie Carbeniumion, AdE2 Mechanismus via cyclische Oniumionen (AE + AN), syn-Additionen, Ionische Hydrierung (Dissolving Metal Reduction), Nucleophile Addition
9 Cycloadditionen
Epoxidierung ([2+1] CA, Cyclopropanierung ([2+1] CA), [2+2]-Cycloaddition, [2+3]-Cycloaddition: Dihydroxylierung (via [2+3] CA mit OsO4) und 1,3-Dipolare Cycloaddition ([2+3]-CA), Diels-Alder-Reaktion ([2+4] CA), Reaktionsbeispiele
10 Radikalreaktionen
Struktur und Eigenschaften der Radikale, Radikalische Substitution, Radikalische Addition
11 Aromatische Substitution
Elektrophile aromatische Substitution (SEAr), Aromatische Substitution mit Nucleophilen (Nucleophile aromatische Substitution (SNAr), Konzertierte SNAr, Oxidative induzierter nucleophiler Angriff, Arin-Mechanismus), Diazoniumsalz Reaktionen (Diazotierung, Azokupplung, Diazoverkochung, Reduktion, Halogenierung)
12 Oxidation und Redoxchemie
Formalismus, Oxidation aktivierter C-H-Bindungen, Spaltung von 1,2-Diolen (Glykolspaltung), Oxidation von Alkoholen, Sonstige Oxidationsreaktionen
Kapitel 13–19: Reaktionen von Carbonylverbindungen
13 Hetero-Nucleophile und Carbonylverbindungen
O-Nucleophile, S-Nucleophile, N-Nucleophile, Weitere Atomübertragungen
14 Acylsubstitutionen mit Heteronucleophilen
Herstellung und Umsetzung von Säurechloriden, Herstellung und Umsetzungen von Säureanhydriden, Herstellung von Carbonsäureestern, Umsetzung von Carbonsäureestern, Carbonsäureamide aus Carbonsäuren – Peptidsynthese, Hydratisierung von Nitrilen / Hydrolyse von Amiden
15 Reduktionen von Carbonylverbindungen und Analogen
Additionen von Hydrid an Carbonylverbindungen und Analoge, Sonstige Reduktionen von Carbonylverbindungen
16 1,2-Addition von Organometallika an C=O und C=Het
Bildung und Eigenschaften von Organometallverbindungen, 1,2-Addition an Aldehyde und Ketone, Addition an Imine, Verzweigte Alkohole aus Carbonsäurederivaten, Ketone aus Carbonsäurederivaten, Carbonsäuren aus Kohlendioxid + Organometallika
17 Enolisierung und Enolate
Enolisierung und Enolgehalte, Alkylierung von Enolaten, α-Halogenierung von Carbonylverbindungen
18 Reaktion acidifizierter C-H Donoren mit C=O / C=N
1,2-Addition von C(sp1)-Carbanionen, Enolate und Heteroenolate als C-Nucleophile, Carbonylolefinierungen, Acylierung C–H-acider Verbindungen
19 Konjugierte Addition (1,4-Addition)
Michael-Addition, Cuprat-Addition, Konjugierte Hydrierung vs. Luche Reduktion, Robinson-Anellierung, Konjugierte Addition von Heteronucleophilen
20 Kondensationen zu Heterocyclen
Aromatische 5-Ring-Heterocyclen, Aromatische 6-Ring-Heterocyclen
21 Umlagerungen
[1,2]-Umlagerungen, [3.3]-sigmatrope Umlagerungen