COOMeth
Neue Katalysatoren zur Hydrierung von
CO2 zu Methan zur Energiespeicherung
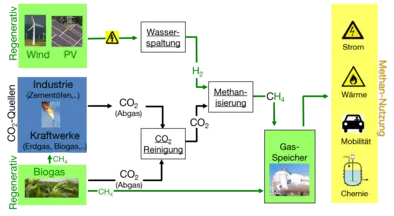
Die chemische Speicherung von Überschusselektrizität als Erneuerbares Methan hat im Gegensatz zur direkten Speicherung von Wasserstoff den großen Vorteil, dass die Speicheroption im Erdgasnetz mit einer sehr hohen Kapazität bereits verfügbar ist. Im Falle eines steigenden Verbrauches kann Erneuerbares Methan wieder in andere Energieformen (Wärme und Strom) überführt werden. Vorteilhaft bei dieser Technologie wäre zudem, dass das notwendige Kohlendioxid im Falle von Verbrennungskraftwerken (z.B. Kohle) ebenfalls vor Ort anfällt.
Die Methanisierung von Synthesegas (CO+H2) ist etabliert und erzielt hohe Effizienzen (ca. 80%, T = 180 -350°C, p = 1 -100 bar). Im Gegensatz dazu ist die reine CO2-Methanisierung Gegenstand der aktuellen Forschung und substanzielle Fragen zu Katalysatoren und Reaktionsführung sind unbeantwortet. Untersuchungen unter Laborbedingungen zeigen zwar interessante Umsätze von 90 % bei Drücken von 6-7 bar und Temperaturen von 280°C [1], aber abgesehen von den dabei verwendeten Standard-Nickel-Trägerkatalysatoren wurde über, Standzeiten, Vergiftungsresistenz und Struktur-Aktivitätsbeziehungen der Katalysatoren wenig veröffentlicht. Die übergroße Mehrheit der Patentliteratur zielt auf die Methanisierung von Kohlenmonoxid, Kohlendioxid wird meist als Verunreinigung betrachtet; Patente mit dem alleinigen Anspruch auf die Methansierung von reinem CO2 wurden nicht gefunden.
Die wissenschaftliche Literatur zur Hydrierung von Kohlendioxid (<100 Publikationen in den vergangenen 20 Jahren) behandelt spezifische Katalysatorsysteme und Fragestellungen, meist unter sehr speziellen Reaktionsbedingungen (Gaszusammensetzung, Temperaturfenster, Volumengeschwindigkeiten) [2, 3]. Vereinzelt werden Reaktorkonzepte zur Beherrschung der stark exothermen Wärmetönung der Reaktion adressiert [4]. Es wurden wenige Studien zum Vergleich verschiedenster Katalysatorsysteme veröffentlicht und das Verständnis von Struktur-Eigenschafts-beziehungen der Katalysatoren ist sehr limitiert [5, 6]. Aktivität und Selektivität der Katalysatoren variieren stark mit der Metall-Hauptkomponente. Beispielsweise katalysieren Nickel, Ruthenium und Rhodium bevorzugt die Bildung von Methan, über Kupfer und Silber entsteht vor allem Methanol; Palladium, Platin und Gold katalysieren weniger selektiv beide Reaktionen. Typische Reaktionstemperaturen liegen zwischen 500 und 700 K [2].
Substanzieller Forschungs- und Entwicklungsbedarf ergibt sich aus der Vielzahl offener Fragen. Dazu gehören auf Katalysatorseite die Suche nach alternativen Katalysatoren (Hauptkomponenten und Promotoren), die Untersuchung der Rolle von Verunreinigungen und Katalysatorvergiftung (H2S führt z.B. zur Vergiftung der Nickel-Katalysatoren), der thermischen Stabilität und Langzeitstabilität der Katalysatoren. Auf reaktionstechnischer Seite sind unter anderem der Einfluss der Gaszusammensetzung (insbes. reines CO2), der Raum-Zeit-Ausbeuten, die Beherrschung der starken Exothermie und die Entwicklung von Katalysatorformen mit geringem Druckverlust wesentlich.
[1] M. Specht, M. Sterner, B. Stürmer, V. Frick, B. Hahn, Renewable Power Methane - Stromspeicherungdurch Kopplung von Strom- und Gasnetz - Wind/PV-to-SNG. Registered by ZSW, on 09.04.2009. Patent No: 10 2009 018 126.1.
[2] J. Wambach, A. Baiker, A. Wokaun, Phys. Chem. Chem. Phys. 1 (1999) 5071.
[3] Y. Borodko, G. A. Somorjai, Appl. Catal. A 186 (1999) 355.
[4] K. P. Brooks, J. Hu, H. Zhu, R. J. Kee, Chem. Eng. Sci. 62 (2007) 1161.
[5] J.-N. Park, E. W. McFarland, J. Catal. 266 (2009) 92.
[6] J. Sehested, K. Larsen, A. Kustov, A. Frey, T. Johannessen, et al., Topics Catal. 45 (2007) 9.